Source: http://blair.pha.jhu.edu/spectroscopy/basics.html
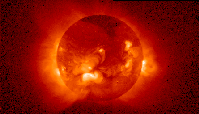

Sunce kao što se pojavljuje u rendgenskom svjetlu (lijevo) i ekstremno ultraljubičasto svjetlo (desno).
Svjetlost kao energija
Svjetlost je izvanredna. To je nešto što svakodnevno uzimamo zdravo za gotovo, ali nije nešto na čemu često zastajemo i razmišljamo ili čak pokušavamo i definirati. Odvojimo nekoliko minuta i isprobajmo neke stvari o svjetlu.
Jednostavno rečeno, svjetlost je prirodni način prijenosa energije kroz svemir. Možemo to zakomplicirati razgovorom o međusobnim električnim i magnetskim poljima, kvantnoj mehanici i svemu tome, ali samo zapamtite – svjetlost je energija.
Svjetlost putuje vrlo brzo, ali ima ograničenu brzinu. U vakuumu je brzina svjetlosti 186.282 milje u sekundi (ili gotovo 300.000 kilometara u sekundi), što stvarno zvuči! Međutim, kad počnemo govoriti o nevjerojatnim udaljenostima u astronomiji, konačna priroda brzine svjetlosti postaje vidljiva. Na primjer, potrebno je oko dvije i pol sekunde da radijska komunikacija putuje brzinom svjetlosti da bi se dosegla do Mjeseca i natrag.

Izlazak sunca iz svemirskog šatla, misija STS-47.
Možda će vam biti zanimljivo sjetiti se, kad sljedeći put kad gledate prekrasan izlazak ili zalazak sunca, da je i sunce zapravo uronilo ispod horizonta osam minuta ranije – potrebno je toliko vremena da svjetlost stigne do Zemlje! I, naravno, svaki članak u novinama koji ste ikada pročitali o astronomiji uvijek će sadržavati traženu izjavu: “Svjetlosna godina je svjetlost na daljinu koja putuje u jednoj godini brzinom od 186.282 milje u sekundi, oko 6 trilijuna milja.” (Pa, 5,8 trilijuna milja zapravo, ali što je 200 milijardi milja među prijateljima?)
Također treba istaknuti desno gore ispred Svjetlost je općenito naziva elektromagnetskog zračenja. Ok, koristili smo veliku riječ. Moralo se dogoditi prije ili kasnije. Ali prečesto kada kažemo „svjetlo”, to je u zabludi da znači „optički svjetlo”, što je otprilike zračenje vidljivo našim očima. Vidljiva svjetlost je mali dio ogromne smorgasboard svjetlosti naziva elektromagnetski spektar. Za naše udobnosti, lomimo ovaj smorgasboard u različite tečajeve (predjelo, salate, itd), a odnose se na njih po imenu, kao što je gama-zrake, X-zrake, ultraljubičasto, optički, infracrveni i radio. Međutim, važno je imati na umu da su sve samo svjetlo, Ne postoje „pauze”, a ne tvrde granice u elektromagnetskom spektru-samo kontinuirani spektar energije.
Čestice i valovi
Fizika eksperimenti u proteklih stotinjak godina pokazala su da svjetlost ima dvostruku prirodu. U mnogim slučajevima, to je zgodan da predstavljaju svjetlost kao „čestica” fenomen, razmišljajući o svjetlu kao diskretne „paketa” energije koje zovemo fotoni. Sada se na ovakav način razmišljanja ne stvaraju svi fotoni jednako, barem s obzirom na to koliko energije sadrže. Svaki foton rendgenske svjetlosti sadrži puno energije u usporedbi s, recimo, optičkom ili radiofonijom. Upravo je ovaj “energetski sadržaj po fotonu” jedno od glavnih karakteristika različitih svjetlosnih opsega opisanih gore. Iako nije strogo točno, teško je ne razmišljati o snopu svjetlosti kao o skupu malih „svjetlosnih metaka“, svi složeni u nizu.
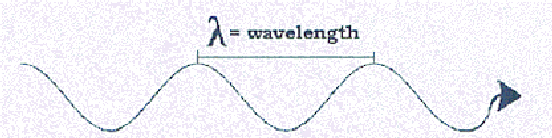
“Valni” model svjetlosti.
Drugi način predstavlja svjetlo je kao val fenomena. To je nešto više teško za većinu ljudi razumjeti, ali možda analogija sa zvučnim valovima će biti korisno. Kada igrate visoku notu i niske note na klaviru, obojica proizvoditi zvuk, ali glavna stvar koja se razlikuje između dviju nota je frekvencija vibracijskog niza proizvodnju zvučne valove-brže vibracija je veći nagib bilješke. Ako mi sada sebe umjesto pomak naš fokus zvučnih valova vibracijskog string, mi bi da su veće utabore bilješke imaju kraće valne duljine ili udaljenost između svake sljedeće vala. Isto tako (i sebe ograničava na optičke svjetlo za trenutak), plavo svjetlo i crveno svjetlo su samo svjetlo, ali je plava svjetlost ima veću učestalost vibracija (ili kraće valne duljine) od crveno svjetlo.
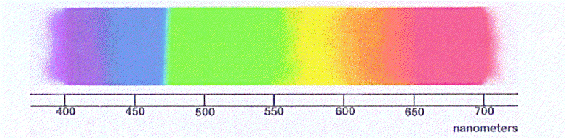
Boje poznate “duge” vidljive svjetlosti odgovaraju različitim valnim duljinama svjetlosti, ovdje prikazane nanometerskom skalom. Valne duljine postaju sve veće kako se čovjek kreće s lijeva na desno. Optička svjetlost radi od oko 400 do 700 nanometara.
To je isti način na koji se krećemo kroz elektromagnetski spektar. Svakom rasponu svjetlosti koji smo definirali gore odgovara rasponu frekvencija (ili valnih duljina) vibracija svjetlosti. Te valne duljine su jedan od glavnih pokazatelja koji koristimo za opisivanje svjetla i spektra na grafu. Prikazivanje spektra kao grafikona umjesto samo trake u boji omogućava nam mjerenje svjetlosti.
Na primjer, “duga” boja prikazana na gornjoj slici ono je što vidite kad prođete bijelu svjetlost kroz prizmu. Ono što možda nije očito je da se “intenzitet” ili svjetlina svjetlosti također mijenjaju zajedno s bojama. Ako bismo “dugu” pretvorili u grafikon intenziteta svjetlosti u odnosu na valnu duljinu, izgledao bi ovako:
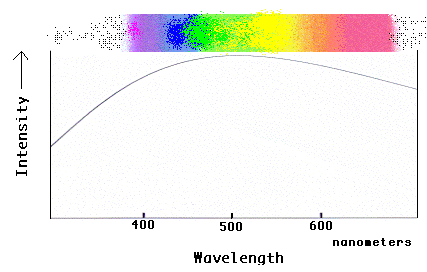
Poznata “duga” vidljivog spektra može se pretvoriti u grafikon koji pokazuje kako se intenzitet svjetlosti mijenja duž spektra.
Primijetite da je spektar najsvjetliji u sredini (žuto-zelena regija) i da ispada u oba smjera (prema crvenoj i plavoj boji). To nije bilo očito iz dugačke verzije spektra! Također primijetite da se “intenzitet” svjetlosti u grafikonu ne zaustavlja na “krajevima” dugačkog spektra koji su vidljivi našim očima! Svjetlost se nastavlja izvan onoga što možemo vidjeti u oba smjera, što možemo vidjeti na grafu, ali ne i gledanjem duge. Astronomi većinu vremena koriste grafičke spektre jer na taj način mogu dobiti više informacija iz svjetlosti i zato što još uvijek mogu crtati i analizirati svjetlost koja nije izravno vidljiva našim očima!
Sada smo spomenuli da je i energija svakog fotona svjetlosti također bila osnovna osobina. Ispada da postoji jednostavan odnos između energije fotona i odgovarajuće valne duljine tog fotona:
E(foton) = (konstanta) / (valna duljina).
Ova jednostavna jednadžba u osnovi povezuje prirodu svjetlosti čestica i vala omogućavajući nam pretvaranje unazad i nazad od valnih duljina do fotona i fotona u njihove valne duljine. Ova jednadžba je također u skladu s onim što smo ranije rekli… rendgenski foton ima veliku energiju (i malu valnu duljinu) u usporedbi s fotonom optičke svjetlosti.
Interakcija svjetlosti s materijom: apsorpcija i emisija svjetlosti
To bi trebao doći kao što ne čudi da vam da atomi i molekule (koji su jednostavno Vezana zbirke dvaju ili više atoma) može apsorbirati svjetlo (= energije!). Ako nisu, možete jednostavno zvrčka svjetlo i isključiti, a zatim sjediti leđa dok su fotoni i dalje odbijaju po sobi! Isto tako, infracrveno svjetlo (= toplina = energija!) Ne bi to bilo dobro u zagrijavanje svog doma u zimi, ako nisu dobili apsorbira tvari. Viši energije svjetlosti fotoni, kao što su X-zrake, imaju tendenciju da žele da ore kroz više stvar prije nego što se apsorbira. (Dakle, njihovo korištenje u medicinske slike: oni mogu proći kroz „meke” tkivo, ali se lakše apsorbira u kostima, koje su gušće.) Kako i zašto fotoni se apsorbira tvari?
Pa, vrijeme je da se razvije još jedan konceptualni uređaj da nam pomogne razumjeti ovaj proces. U fizici, mi često naći korisne pretvarati gledamo jednog atoma. Atomi se sastoje od protona, neutrona i elektrona, a svaki kemijski element ima određeni broj njih-to je ono što ih čini različitim! Protoni (i neutroni) su masivniji od elektrona, pa smo ponekad vizualizirati atom kao minijaturni Sunčevog sustava, s teškim čestica u centru (nukleusa) i elektrona pomrsiti konce oko u određene „orbita” kao planeta. (U stvarnosti, ova slika nije baš točna. Elektroni su ne Smatra se da malo loptice „u orbiti” oko nuklearnog „sunca”. No, ako ste dobili ideju da se elektroni naći samo u određenim, diskretni „udaljenosti” iz jezgre, te da svaka dopušteni razmak odgovara drugačiji „ razina energije”za elektron, koji će biti bliže stvarnosti).
Bez udubljivanja u atomskoj fizici i kvantnoj mehanici predaleko, neka nam samo uzeti sljedeću izjavu zdravo za gotovo, za sada: elektroni vezani za neki određeni atom može naći samo u određenim, specifičnim razina energije u odnosu na atom jezgre. Vodikov atom ima samo jedan proton i jedan elektron, a najjednostavniji (a najčešće) element u svemiru, pa ćemo koristiti kao primjer. Brojka [TBD] prikazuje shematski atom vodika, gdje umjesto crtanja dopuštene „orbite” za elektrona crpimo okomito raseljeni linije predstavljaju dopušteni razinu energije za elektrona.
Ako ostane nedirnuto, naš atom vodika voli vezati svoj elektron kao čvrsto kao što se može, pa ćemo naći elektron u na najnižu razinu energije, koja se zove „osnovno stanje.” Međutim, ako naš atom uronjen u snopu svjetla od, recimo, obližnje zvijezde, prije ili kasnije atom će se susresti foton s energijom koja je samo pravo iznos za skok elektrona na sljedeću višu razinu energije. Voila! Foton se apsorbira, a „otišao” iz snopa svjetlosti koja dolazi od zvijezde! Budući da apsorbira foton ima specifičnu energiju, to apsorpcija odvija na određene valne duljine u spektru.
Sada naš vodikov atom u ono što se naziva „uzbuđeni” stanje, nešto kao klinac prava pred Noć vještica. Međutim, kao što svi roditelji znaju, to nije prirodno stanje djeteta, a to nije prirodno stanje atoma bilo. Ako nema drugih fotona apsorbira u atom, elektron na kraju će pasti natrag na donjem prizemlju energetsko stanje. Međutim, atom mora izgubiti energiju za to, i tako oslobađa foton iste energije kao onaj što apsorbira (iako vjerojatno u nekom drugom smjeru iz kojeg je apsorbira). Ovaj proces se naziva emisije, jer foton svjetlosti koju emitira atom, opet na vrlo određene valne duljine.
Naravno, atom mogao apsorbirati drugi foton s pravom energije za skok još jednu razinu energije, ili čak dva ili tri ili više. Isto tako, nakon svakog od tih mogućih pobuđenja atoma, elektron može skočiti natrag dolje jedan ili više koraka, emitira fotone kao što je otišao. Ako foton s dovoljno velikim energije se apsorbira, to čak može izazvati elektron postati nevezani iz svoje jezgre, što je proces koji se naziva ionizacija. Naš osakaćen vodika tada više nije mogao apsorbirati ili emitiraju svjetlo dok se ne uspije uhvatiti slobodan elektronski natrag u vezanom razinu energije.
Mi smo bili raspravljali jednu specifičnu tranziciju ili „energetski skok” u jednom atomu, ali, naravno, u bilo kojem fizičkom sustavu postoji mnogo atomi. U plinu vodika, svi zasebni atoma može biti apsorbira i emitira fotone odgovaraju cijelom skupinu „dopušteno” prijelaze između različitih razina energije, od kojih je svaki bi se apsorbiraju ili emitiraju na određenim valnim duljinama koje odgovaraju energetske razlikama između razina energije. Ovaj obrazac apsorpcije (ili emisija) je jedinstven za vodik-ni drugi element može imati isti obrazac-a uzrokuje prepoznatljiv uzorak apsorpcije (ili emisija) linija u spektru.
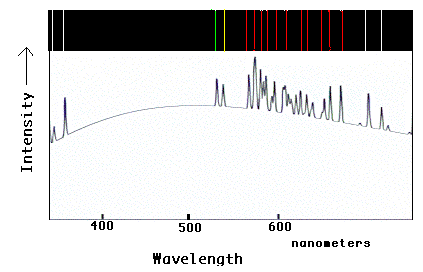
Ova grafika prikazuje optički spektar koji bi se vidio iz užarenog neonskog plina, u boji i grafički format. Kao i s vodikom, o kojem se raspravlja u tekstu, neon pokazuje specifičan skup spektralnih linija. Napominjemo kako svaka linija jarke boje u traci s bojama odgovara uzlaznom “šiljku” u grafičkom formatu. Budući da se većina linija nalazi u žutoj i crvenoj regiji optičkog spektra, neonska žarulja pojavljuje se “narančasto” vašem oku. Prisutnost ovog obrasca linija u spektru užarenog oblaka u svemiru rekla bi astronomima da oblak sadrži neon u plinu.
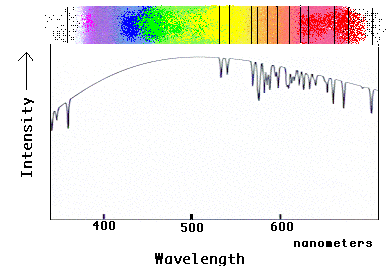
Ovaj dijagram prikazuje kako bi se u spektru neke zvijezde pojavio spektar neona. Ovdje pozadinska “duga” dolazi iz atmosfere zvijezde, a neonski atomi u atmosferi zvijezde (ili vanjskih slojeva) apsorbiraju svjetlost zvijezda, ostavljajući tamne linije. Imajte na umu kako se na grafu prikazuje padova na svakoj poziciji linije, stvarajući karakteristični uzorak linija koje se očekuju od neona.
Proširejući ovo malo, trebalo bi postati jasno da budući da svaki kemijski element ima svoj jedinstveni skup dozvoljenih razina energije, svaki element ima i svoj karakteristični obrazac spektralnih apsorpcijskih (i emisijskih) linija! (Pogledajte gornje dijagrame za neon, na primjer.) Taj spektralni “otisak prsta” astronomi koriste za prepoznavanje prisutnosti različitih kemijskih elemenata u astronomskim objektima. Spektralne crte omogućuju nam iz „spektra“ da izvučemo toliko informacija o promatranom objektu!
Bill Blair ([email protected])
